高考化學二輪復習物質的分類知識專題總結
2019-01-07 17:25:15三好網
要點一、簡單分類法
1.分類法的涵義:
分類是根據對象的共同點和差異性,將對象區分為不同的種類,并且形成有一定從屬關系的不同等級的系統的邏輯方法。它也是研究和學習化學物質及其變化的一種常用的科學方法。
2.分類的方法:
分類根據不同的標準,可以有不同的分類方法。交叉分類法和樹狀分類法是兩種常用的、具體的分類方法。要點詮釋:分類中要注意的問題
(1)確定分類的標準:當分類的標準確定后,同類事物在某些方面的相似性可以幫助我們舉一反三;對不同類事物的了解使我們有可能做到由此及彼。
(2)認識事物時往往需要采用多種分類方法(如“交叉分類”法),以彌補單一分類法的不足,提供關于事物的更多方面的信息。例如,利用交叉分類法,Na2CO3既可以是鈉鹽,也可以是碳酸鹽。又如,以下四種酸的交叉分類見下圖:

(3)對同類事物進行再分類,即采用“樹狀分類”法。
樹狀分類法:確定更細的標準,對同一類物質進行再分類。這種分類法便于系統認識物質,強調了不同類別物質的內在聯系,每一類物質之間沒有交叉關系,培養了思維的系統性和嚴謹性。
要點二、化學物質的樹狀分類法
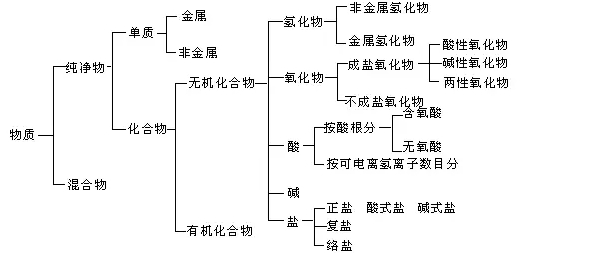
要點詮釋:
【物質的分類】
1.氧化物:
(1)氧化物的分類
從組成元素分:金屬氧化物,如CuO、Al2O3; 非金屬氧化物,如CO、CO2;
從性質上分:

(2)注意:
①.非金屬氧化物不一定是酸性氧化物,如CO 、H2O屬不成鹽氧化物;
②. 金屬氧化物不一定是堿性氧化物,如Mn2O7屬酸性氧化物;
③. 酸性氧化物不一定是非金屬氧化物,Mn2O7屬金屬氧化物;
④. 堿性氧化物一定是金屬氧化物。
2.酸:
按酸是否含氧元素,可分為

H2SO4按照上面的分類可以是二元酸、強酸、穩定性酸、難揮發性酸。
3.堿:
按溶解性,可分為

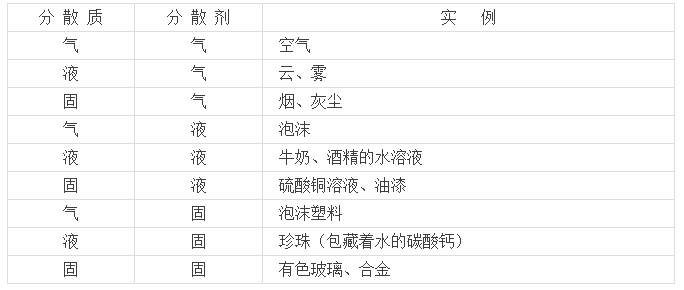
要點三、分散系及其分類
1、分散系定義:把一種(或多種)物質分散在另一種(或多種)物質中所得到的體系,叫做分散系。前者屬于被分散的物質,稱作分散質;后者起容納分散質的作用,稱作分散劑。
要點詮釋:
按照分散質或分散劑的聚集狀態(氣、固、液)來分,分散系可以有以下9種組合:
2.溶液、膠體和濁液——三種分散系的比較
不同的分散系,其外觀、組成等不同,其根本原因是分散質粒子大小不同。現將三種分散系的比較列于下表中。
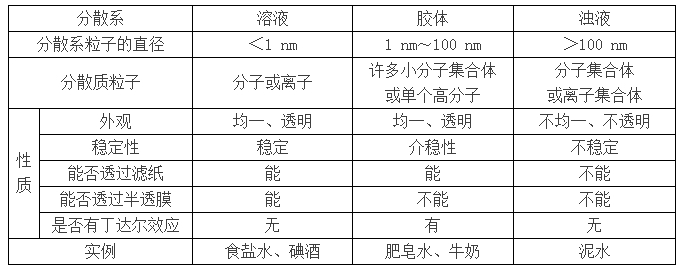
要點詮釋:
當分散劑是水或其他液體時,按照分散質粒子的大小,可以把分散系分為溶液、膠體和濁液。溶液中分散質粒子小于1nm,溶液中的分散質我們也稱為溶質;濁液中的分散質粒子通常大于100nm;膠體中的膠體粒子大小在1nm~100nm之間。因此,溶液和膠體的分散質都能通過濾紙,而懸濁液的分散質則不能通過濾紙。
這三類分散質中,溶液最穩定;濁液很不穩定,分散質在重力作用下會沉降下來;膠體在一定條件下能穩定存在,穩定性介于溶液和濁液之間,屬于介穩體系。
要點四、膠體及其性質
1、定義:分散質粒子大小在1nm~100nm之間的分散系稱為膠體。
我們把這些分散質粒子稱為膠體粒子。膠體具有一些不同于溶液和濁液的特性:
2、Fe(OH)3膠體的制備和精制:
(1)Fe(OH)3膠體的制備:向燒杯中煮沸的蒸餾水中逐滴加入5~6滴FeCl3飽和溶液,繼續加熱煮沸至溶液呈紅褐色,就得到Fe(OH)3膠體。FeCl3+3H2O Fe(OH)3 (膠體)+3HCl使一束光線通過所得液體混合物,有丁達爾效應,證明形成了膠體。
(2)膠體的提純與精制——滲析:利用半透膜將溶液和膠體分離的操作。滲析是利用溶質粒子能通過半透膜而膠體粒子不能通過半透膜進行溶液和膠體的分離。但滲析過程是可逆的,要達到分離目的應反復進行滲析或在流水中進行滲析。
3、膠體的性質:丁達爾效應
一束光通過膠體時會產生一條光亮的通路,這種現象叫丁達爾效應。丁達爾效應是區分溶液和膠體的物理方法。
要點五、各類物質間的相互關系一-無機反應規律
酸堿鹽氧化物之間的相互關系如下圖所示:
【物質的分類】
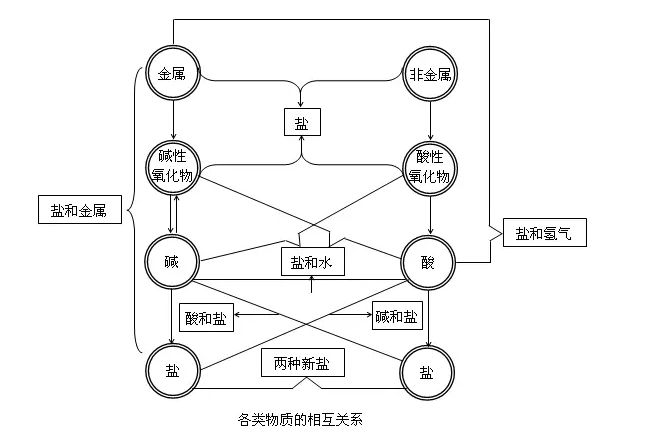
要點詮釋:
既要掌握其所屬類別的通性,還要掌握這種物質的特性。例如,酸與金屬反應可以生成氫氣和鹽,這是一般規律,但并不是所有的酸和金屬反應都產生H2;金屬氧化物不都是堿性氧化物(如Mn2O7是酸性氧化物);堿性氧化物不都能與水反應生成相應的堿,如Fe2O3與H2O不反應。
(一)金屬的性質:
1、與非金屬的反應,可得無氧酸鹽或金屬氧化物。
2、與酸反應
(1)金屬活動表H前面的金屬與酸發生置換反應生成鹽和H2
(2)金屬與HNO3、濃H2SO4不發生置換反應
3、與鹽溶液反應
(1)在金屬活動順序表中,排在前面的金屬將后面的金屬從鹽溶液中置換出來。例如:Fe+CuSO4=Cu+FeSO4
(2)K、Na、Ca等非常活潑的金屬與鹽溶液不直接發生置換反應,其反應比較復雜。
(二)非金屬的性質
1、與金屬反應
2、與非金屬反應
3、與氫氣反應
4、與H2O的反應 C+H2O(氣) CO+H2
(三)堿性氧化物的性質
1、與H2O反應: 堿性氧化物(易溶)+H2O→堿(易溶)
例如:K2O+H2O=2KOH CaO+H2O=Ca(OH)2
2、與酸性氧化物反應:堿性氧化物+酸性氧化物→含氧酸鹽
例如:Na2O+SO3=Na2SO4
3、與酸反應:堿性氧化物+酸→含氧酸鹽+水;例如CuO+2HNO3=Cu(NO3)2+H2O
(四)酸性氧化物發生的反應
1、與水反應:酸性氧化物+水→酸 例如:SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4;
注意:SiO2難溶于水,不與水反應
2、與堿性氧化物反應:堿性氧化物+酸性氧化物→含氧酸鹽
3、與堿反應:酸性氧化物+堿→鹽+水;例如CO2+2NaOH=Na2CO3+H2O
注意:難溶性的堿與酸性氧化物不反應
(五)堿的性質
1、與酸性氧化物反應:堿+酸性氧化物→鹽+水
2、與酸反應: 堿+酸+鹽+水
3、與鹽反應:強堿+弱堿鹽→弱堿+強堿鹽 即強堿制弱堿
例如:3NaOH+FeCl3=Fe(OH)3↓+3NaCl;
KOH+NH4Cl=NH3·H2O+KCl,若反應物是濃溶液或加熱時,則NH3·H2O分解生成NH3↑+H2O
4、難溶性堿的不穩定性:難溶性堿受熱易分解, 難溶性堿性氧化物+水
例如:Cu(OH)2 CuO+H2O ; 2Fe(OH)3Fe2O3+3H2O
強堿穩定,受熱難分解
(六)酸的性質
1、與金屬反應(見前述)
2、與堿性氧化物反應:酸+堿性氧化物→含氧酸鹽+水;例如CuO+2HNO3=Cu(NO3)2+H2O
3、與堿反應:堿+酸 鹽+水
4、與鹽反應: 強酸+弱酸鹽→弱酸+強酸鹽 ,即強酸制弱酸
例如:2HCl+Na2CO3=2NaCl+H2O+CO2↑
(七)鹽的性質
1、與金屬反應(見前述)
2、與堿反應(見前述)
3、與酸反應(見前述)
4、與鹽反應: 鹽+鹽→生成兩種新鹽; 生成物要有沉淀
例如:CaCl2+Na2CO3=CaCO3↓+2NaCl; BaCl2+Na2SO4=BaSO4↓+2NaCl














