高考化學(xué)二輪復(fù)習(xí)物質(zhì)結(jié)構(gòu)知識點專題總結(jié)
2019-01-07 17:09:22三好網(wǎng)
一、原子核外電子運動狀態(tài),了解電子云、電子層(能層)、原子軌道(能級)的含義.
1.電子云:用小黑點的疏密來描述電子在原子核外空間出現(xiàn)的機會大小所得的圖形叫電子云圖.離核越近,電子出現(xiàn)的機會大,電子云密度越大;離核越遠,電子出現(xiàn)的機會小,電子云密度越小.
電子層(能層):根據(jù)電子的能量差異和主要運動區(qū)域的不同,核外電子分別處于不同的電子層.原子由里向外對應(yīng)的電子層符號分別為K、L、M、N、O、P、Q.
原子軌道(能級即亞層):處于同一電子層的原子核外電子,也可以在不同類型的原子軌道上運動,分別用s、p、d、f表示不同形狀的軌道,s軌道呈球形、p軌道呈紡錘形,d軌道和f軌道較復(fù)雜.各軌道的伸展方向個數(shù)依次為1、3、5、7.
2.(構(gòu)造原理)
了解多電子原子中核外電子分層排布遵循的原理,能用電子排布式表示1~36號元素原子核外電子的排布.
(1).原子核外電子的運動特征可以用電子層、原子軌道(亞層)和自旋方向來進行描述.在含有多個核外電子的原子中,不存在運動狀態(tài)完全相同的兩個電子.
(2).原子核外電子排布原理.
①.能量最低原理:電子先占據(jù)能量低的軌道,再依次進入能量高的軌道.
②.泡利不相容原理:每個軌道最多容納兩個自旋狀態(tài)不同的電子.
③.洪特規(guī)則:在能量相同的軌道上排布時,電子盡可能分占不同的軌道,且自旋狀態(tài)相同.
洪特規(guī)則的特例:在等價軌道的全充滿(p6、d10、f14)、半充滿(p3、d5、f7)、全空時(p0、d0、f0)的狀態(tài),具有較低的能量和較大的穩(wěn)定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.
(3).掌握能級交錯圖和1-36號元素的核外電子排布式.
①根據(jù)構(gòu)造原理,基態(tài)原子核外電子的排布的順序。
②根據(jù)構(gòu)造原理,可以將各能級按能量的差異分成能級組,由下而上表示七個能級組,其能量依次升高;在同一能級組內(nèi),從左到右能量依次升高。基態(tài)原子核外電子的排布按能量由低到高的順序依次排布。
3.元素電離能和元素電負性
第一電離能:氣態(tài)電中性基態(tài)原子失去1個電子,轉(zhuǎn)化為氣態(tài)基態(tài)正離子所需要的能量叫做第一電離能。常用符號I1表示,單位為kJ/mol。
(1).原子核外電子排布的周期性.
隨著原子序數(shù)的增加,元素原子的外圍電子排布呈現(xiàn)周期性的變化:每隔一定數(shù)目的元素,元素原子的外圍電子排布重復(fù)出現(xiàn)從ns1到ns2np6的周期性變化.
(2).元素第一電離能的周期性變化.
隨著原子序數(shù)的遞增,元素的第一電離能呈周期性變化:
同周期從左到右,第一電離能有逐漸增大的趨勢,稀有氣體的第一電離能最大,堿金屬的第一電離能最小;
同主族從上到下,第一電離能有逐漸減小的趨勢.
說明:
①同周期元素,從左往右第一電離能呈增大趨勢。電子亞層結(jié)構(gòu)為全滿、半滿時較相鄰元素要大即第ⅡA族、第ⅤA族元素的第一電離能分別大于同周期相鄰元素。Be、N、Mg、P
②.元素第一電離能的運用:
a.電離能是原子核外電子分層排布的實驗驗證.
b.用來比較元素的金屬性的強弱.I1越小,金屬性越強,表征原子失電子能力強弱.
(3).元素電負性的周期性變化.
元素的電負性:元素的原子在分子中吸引電子對的能力叫做該元素的電負性。
隨著原子序數(shù)的遞增,元素的電負性呈周期性變化:同周期從左到右,主族元素電負性逐漸增大;同一主族從上到下,元素電負性呈現(xiàn)減小的趨勢.
電負性的運用:
a.確定元素類型(一般>1.8,非金屬元素;<1.8,金屬元素).
b.確定化學(xué)鍵類型(兩元素電負性差值>1.7,離子鍵;<1.7,共價鍵).
c.判斷元素價態(tài)正負(電負性大的為負價,小的為正價).
d.電負性是判斷金屬性和非金屬性強弱的重要參數(shù)(表征原子得電子能力強弱).
二.化學(xué)鍵與物質(zhì)的性質(zhì).
內(nèi)容:離子鍵――離子晶體
1.理解離子鍵的含義,能說明離子鍵的形成.了解NaCl型和CsCl型離子晶體的結(jié)構(gòu)特征,能用晶格能解釋離子化合物的物理性質(zhì).
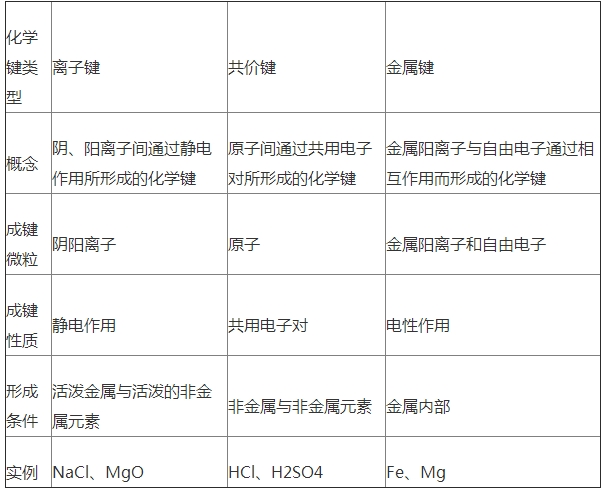
(1).化學(xué)鍵:相鄰原子之間強烈的相互作用.化學(xué)鍵包括離子鍵、共價鍵和金屬鍵.
(2).離子鍵:陰、陽離子通過靜電作用形成的化學(xué)鍵.
離子鍵強弱的判斷:離子半徑越小,離子所帶電荷越多,離子鍵越強,離子晶體的熔沸點越高.
離子鍵的強弱可以用晶格能的大小來衡量,晶格能是指拆開1mol離子晶體使之形成氣態(tài)陰離子和陽離子所吸收的能量.晶格能越大,離子晶體的熔點越高、硬度越大.
離子晶體:通過離子鍵作用形成的晶體.
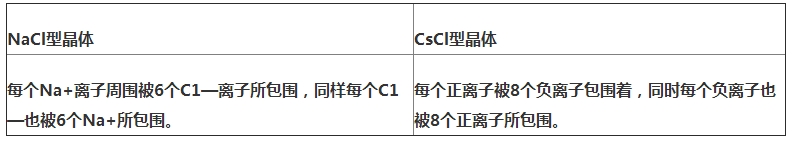
典型的離子晶體結(jié)構(gòu):NaCl型和CsCl型.氯化鈉晶體中,每個鈉離子周圍有6個氯離子,每個氯離子周圍有6個鈉離子,每個氯化鈉晶胞中含有4個鈉離子和4個氯離子;氯化銫晶體中,每個銫離子周圍有8個氯離子,每個氯離子周圍有8個銫離子,每個氯化銫晶胞中含有1個銫離子和1個氯離子.
(3)晶胞中粒子數(shù)的計算方法--均攤法.
2.了解共價鍵的主要類型σ鍵和π鍵,能用鍵能、鍵長、鍵角等數(shù)據(jù)說明簡單分子的某些性質(zhì)(對σ鍵和π鍵之間相對強弱的比較不作要求).
(1)共價鍵的分類和判斷:σ鍵(“頭碰頭”重疊)和π鍵(“肩碰肩”重疊)、極性鍵和非極性鍵,還有一類特殊的共價鍵-配位鍵.
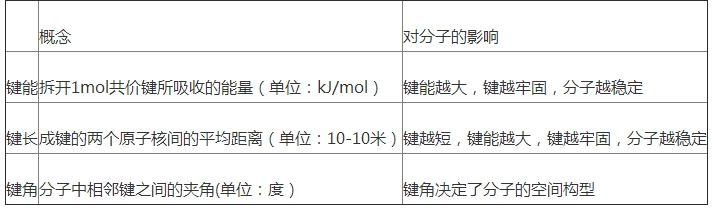
(2)共價鍵三參數(shù).

共價鍵的鍵能與化學(xué)反應(yīng)熱的關(guān)系:反應(yīng)熱=所有反應(yīng)物鍵能總和-所有生成物鍵能總和.
3.了解極性鍵和非極性鍵,了解極性分子和非極性分子及其性質(zhì)的差異.
(1)共價鍵:原子間通過共用電子對形成的化學(xué)鍵.
(2)鍵的極性:
極性鍵:不同種原子之間形成的共價鍵,成鍵原子吸引電子的能力不同,共用電子對發(fā)生偏移.
非極性鍵:同種原子之間形成的共價鍵,成鍵原子吸引電子的能力相同,共用電子對不發(fā)生偏移.
(3)分子的極性:
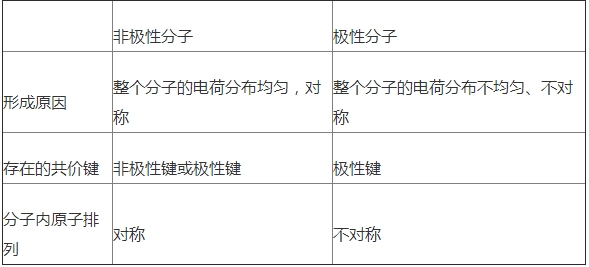
①極性分子:正電荷中心和負電荷中心不相重合的分子.
非極性分子:正電荷中心和負電荷中心相重合的分子.
②分子極性的判斷:分子的極性由共價鍵的極性及分子的空間構(gòu)型兩個方面共同決定.
非極性分子和極性分子的比較
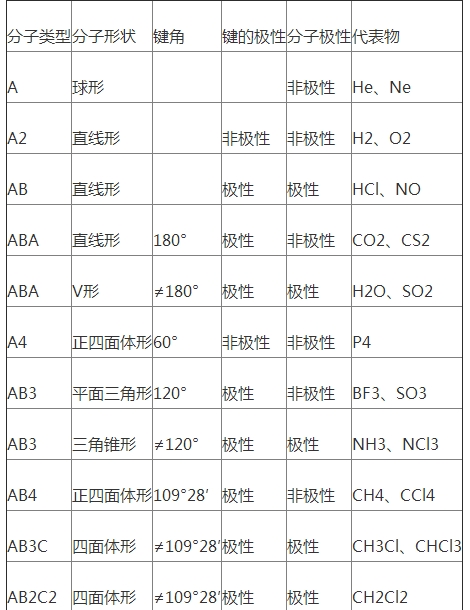
4.分子的空間立體結(jié)構(gòu)
常見分子的類型與形狀比較
了解原子晶體的特征,能描述金剛石、二氧化硅等原子晶體的結(jié)構(gòu)與性質(zhì)的關(guān)系.
(1)原子晶體:所有原子間通過共價鍵結(jié)合成的晶體或相鄰原子間以共價鍵相結(jié)合而形成空間立體網(wǎng)狀結(jié)構(gòu)的晶體.
(2)典型的原子晶體有金剛石(C)、晶體硅(Si)、二氧化硅(SiO2)
金剛石是正四面體的空間網(wǎng)狀結(jié)構(gòu),最小的碳環(huán)中有6個碳原子,每個碳原子與周圍四個碳原子形成四個共價鍵;晶體硅的結(jié)構(gòu)與金剛石相似;二氧化硅晶體是空間網(wǎng)狀結(jié)構(gòu),最小的環(huán)中有6個硅原子和6個氧原子,每個硅原子與4個氧原子成鍵,每個氧原子與2個硅原子成鍵.
(3)共價鍵強弱和原子晶體熔沸點大小的判斷:原子半徑越小,形成共價鍵的鍵長越短,共價鍵的鍵能越大,其晶體熔沸點越高.如熔點:金剛石>碳化硅>晶體硅.
6.理解金屬鍵的含義,能用金屬鍵的自由電子理論解釋金屬的一些物理性質(zhì).知道金屬晶體的基本堆積方式,了解常見金屬晶體的晶胞結(jié)構(gòu)(晶體內(nèi)部空隙的識別、與晶胞的邊長等晶體結(jié)構(gòu)參數(shù)相關(guān)的計算不作要求).
(1).金屬鍵:金屬離子和自由電子之間強烈的相互作用.
請運用自由電子理論解釋金屬晶體的導(dǎo)電性、導(dǎo)熱性和延展性.
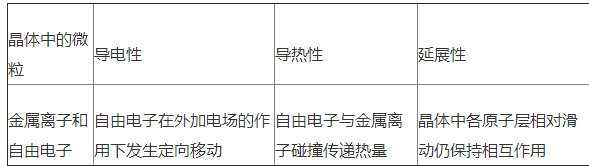
(2)①金屬晶體:通過金屬鍵作用形成的晶體.
②金屬鍵的強弱和金屬晶體熔沸點的變化規(guī)律:陽離子所帶電荷越多、半徑越小,金屬鍵越強,熔沸點越高.如熔點:Na<Mg<Al,Li>Na>K>Rb>Cs.金屬鍵的強弱可以用金屬的原子
7.了解簡單配合物的成鍵情況(配合物的空間構(gòu)型和中心原子的雜化類型不作要求).
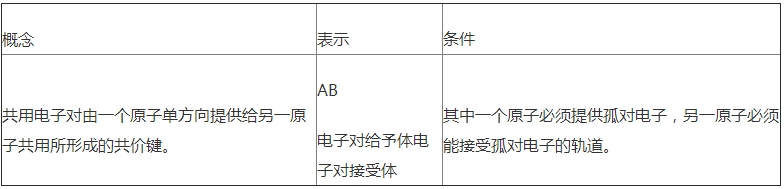
(1)配位鍵:一個原子提供一對電子與另一個接受電子的原子形成的共價鍵.即成鍵的兩個原子一方提供孤對電子,一方提供空軌道而形成的共價鍵.
(2)①.配合物:由提供孤電子對的配位體與接受孤電子對的中心原子(或離子)以配位鍵形成的化合物稱配合物,又稱絡(luò)合物.
②形成條件:a.中心原子(或離子)必須存在空軌道.b.配位體具有提供孤電子對的原子.
③配合物的組成.
④配合物的性質(zhì):配合物具有一定的穩(wěn)定性.配合物中配位鍵越強,配合物越穩(wěn)定.當(dāng)作為中心原子的金屬離子相同時,配合物的穩(wěn)定性與配體的性質(zhì)有關(guān).
三.分子間作用力與物質(zhì)的性質(zhì).
1.知道分子間作用力的含義,了解化學(xué)鍵和分子間作用力的區(qū)別.
分子間作用力:把分子聚集在一起的作用力.分子間作用力是一種靜電作用,比化學(xué)鍵弱得多,包括范德華力和氫鍵.
范德華力一般沒有飽和性和方向性,而氫鍵則有飽和性和方向性.
2.知道分子晶體的含義,了解分子間作用力的大小對物質(zhì)某些物理性質(zhì)的影響.
(1).分子晶體:分子間以分子間作用力(范德華力、氫鍵)相結(jié)合的晶體.典型的有冰、干冰.
(2).分子間作用力強弱和分子晶體熔沸點大小的判斷:組成和結(jié)構(gòu)相似的物質(zhì),相對分子質(zhì)量越大,分子間作用力越大,克服分子間引力使物質(zhì)熔化和氣化就需要更多的能量,熔、沸點越高.但存在氫鍵時分子晶體的熔沸點往往反常地高.
3.了解氫鍵的存在對物質(zhì)性質(zhì)的影響(對氫鍵相對強弱的比較不作要求).
NH3、H2O、HF中由于存在氫鍵,使得它們的沸點比同族其它元素氫化物的沸點反常地高.
影響物質(zhì)的性質(zhì)方面:增大溶沸點,增大溶解性
表示方法:X—H……Y(N O F)一般都是氫化物中存在.
4.了解分子晶體與原子晶體、離子晶體、金屬晶體的結(jié)構(gòu)微粒、微粒間作用力的區(qū)別.
四、幾種比較
1、離子鍵、共價鍵和金屬鍵的比較
2、非極性鍵和極性鍵的比較

3.物質(zhì)溶沸點的比較(重點)
(1)不同類晶體:一般情況下,原子晶體>離子晶體>分子晶體
(2)同種類型晶體:構(gòu)成晶體質(zhì)點間的作用大,則熔沸點高,反之則小。
①離子晶體:離子所帶的電荷數(shù)越高,離子半徑越小,則其熔沸點就越高。
②分子晶體:對于同類分子晶體,式量越大,則熔沸點越高。
③原子晶體:鍵長越小、鍵能越大,則熔沸點越高。
(3)常溫常壓下狀態(tài)
①熔點:固態(tài)物質(zhì)>液態(tài)物質(zhì)
②沸點:液態(tài)物質(zhì)>氣態(tài)物質(zhì)














