高一上學期化學離子反應問題解析總結
2019-01-10 21:49:01三好網
一、電解質、非電解質、強電解質、弱電解質
1、電解質、非電解質
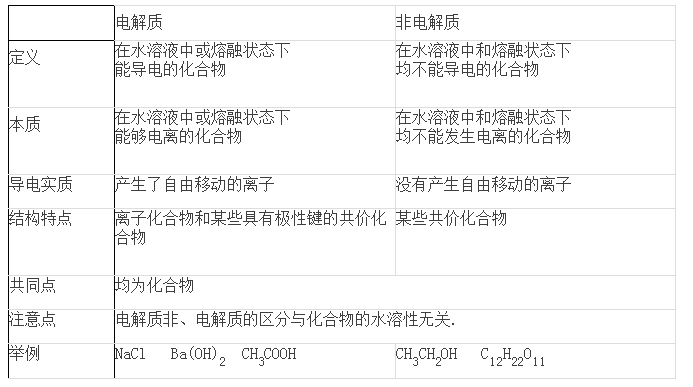


例1:下列物質屬于電解質的是( )
A.Na2O
B.SO3
C.Cu
D.NaCl溶液
【解析】 Na2O為離子化合物,在熔融條件下能導電,為電解質,故A正確;SO3為共價化合物,在熔融條件下不能導電,其水溶液能導電是SO3與水反應生成的H2SO4導電,故SO3為非電解質,B不正確;Cu是單質,NaCl溶液為混合物,它們既不是電解質,也不是非電解質,故C、D都不正確。
【答案】A
特別提醒:
(1)電解質是指在水溶液中或熔融狀態下能夠導電的化合物。水溶液中或熔融狀態下,這兩者之間只需滿足一者就行了,但必須強調的是其本身能夠導電,而不是反應的生成物。如SO2、SO3的水溶液雖然能導電,但它們都不是電解質,原因是在溶液中真正起到導電作用的是它們與水反應的生成物H2SO3、H2SO4,而不是它們自己本身。Na2O的水溶液的導電雖然也是它與水反應生成的NaOH導電,但因為其在熔融狀態下本身能夠導電,所以Na2O是電解質。
(2)電解質和非電解質都是化合物,單質它既不是電解質,也不是非電解質。
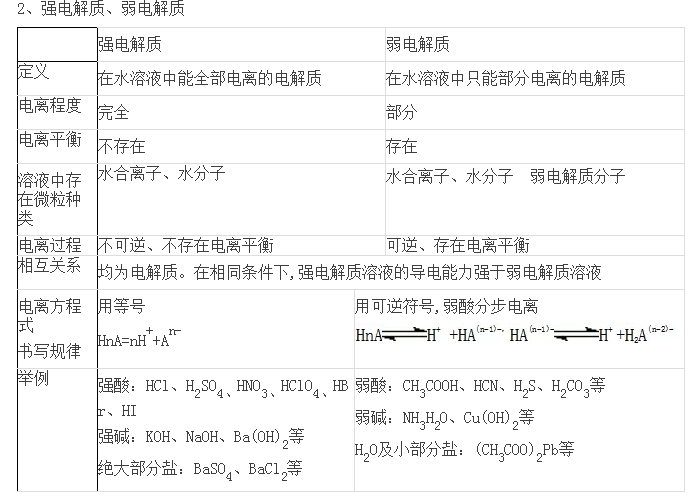
(3)判斷某電解質是強電解質還是弱電解質關鍵是看它在水溶液中電離時是完全電離還是部分電離,與其溶解度大小、導電能力強弱等因素無關。
二、離子方程式的書寫
1、離子反應:指在溶液中(或熔化狀態下)有離子參加或離子生成的反應。
2、離子方程式:用實際參加反應的離子符號表示化學反應的式子。
3、離子方程式的書寫:
(1)書寫規則:
①單質、氧化物、不溶物、難電離的物質(弱酸、弱堿及水等)不能拆開來寫。如Cl2、Na2O等不可以拆開寫成Cl-、Na+、O2-;BaSO4不可以拆開寫成Ba2+、SO42-形式。
②易溶于水,易電離的物質的離子符號的改寫同電離方程式中的離子形式。如NaHCO3改寫Na+、HCO3-;NaHSO4應改寫Na+,H+,SO42-
③微溶物,若出現在反應物中一般改寫成離子符號(懸濁液除外);若出現在生成物中一般不改寫。
④固體與固體物質反應不寫離子方程式。如實驗室制取NH3的離子方程式為:
⑤濃H2SO4、濃H3PO4一般不拆開寫成離子形式;HCl、HNO3無論濃稀,均應改寫成離子符號。如Cu片與濃H2SO4反應的離子方程式為:
(2)書寫步驟(以CuSO4溶液與BaCl2 溶液反應為)
①寫出反應的化學方程式:
②把易溶于水、易電離的物質拆開寫成離子形式,難溶的物質或難電離的物質以及氣體等仍用化學式來表示。上述化學方程式可改寫成:Cu2++SO42+Ba2++2Cl-=Cu2++2Cl-+BaSO4↓
例2:(2008·上海)下列離子方程式書寫正確的是( )
A.AgNO3溶液中滴入少量的Na2S溶液 2Ag+ + S2-==Ag2S↓
B.過量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O==HCO3-+HClO
C.向Na2CO3溶液中加入過量CH3COOH溶液 CO32-+2H+==CO2↑+H2O
D.向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-==BaSO3↓+SO32-+2H2O
【解析】CH3COOH為弱電解質,不可拆開寫成離子形式,故C不正確;因加入的NaHSO3溶液少量,則在反應中Ba(OH)2過量,書寫離子方程式時應以少量的NaHSO3為主,其離子方程式應為:HSO3-+Ba2++OH-==BaSO3↓+ H2O,故D不正確。
【答案】AB
三、溶液中的離子共存
1、離子共存條件:
同一溶液中若離子間符合下列任意一個條件就會發生離子反應,它們之間便不能在溶液中大量共存。
⑴生成難溶物或微溶物:如:Ba2+與CO32-,Ag+與Br-,Ca2+與SO42-等不能大量共存。
⑵生成氣體或揮發性物質:
如:NH4+與OH-,H+與CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等不能大量共存。
⑶生成難電離物質:如:H+與CH3COO-、CO32-、S2-、SO32-等因生成弱酸不能大量共存;OH-與NH4+因生成的弱堿不能大量共存;H+與OH-生成水不能大量共存。
⑷發生氧化還原反應:
氧化性離子(如Fe3+、NO3-、ClO-、MnO4-(H+)等)與還原性離子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
2、附加隱含條件的應用規律:
⑴溶液無色透明時,則溶液中一定沒有有色離子,如Cu2+、Fe3+、Fe2+、MnO4-
⑵強堿性溶液中肯定不存在與OH-反應的離子,如Fe3+、 Fe2+、HCO3-、NH4+、Al3+
⑶強酸性溶液中肯定不存在與H+反應的離子,如HCO3-、CO32-、S2-、CH3COO-、AlO2-
例3:(2008·全國理綜)在溶液中加入少量Na2O2后仍能大量共存的離子組是( )
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
【解析】由題意知,往溶液中加入少量Na2O2后,①Na2O2會與原溶液中的水反應生成NaOH,使溶液呈堿性,故NH4+、Mg2+、HCO3-不能與其大量共存,A、C不正確;②Na2O2有強氧化性,會氧化溶液中的一些還原性離子,如Fe2+、SO32-等,故D不正確。
四、為什么會有離子反應?什么樣的反應是離子反應?
(一)離子反應:















